김빛내리 서울대 석좌교수 사이언스에 발표
코로나 백신 이어 암 치료제로 주목받는 mRNA
세포막 통과하고 분해 막는 원리 밝혀
국내 연구진이 mRNA(전령리보핵산) 백신이 세포에 전달되고 분해되는 데 관여하는 단백질들을 새로 찾아냈다. 이 단백질들을 조절하면 치료용 mRNA의 효능을 높이고 수명도 늘릴 수 있어 안전하고 효율적인 백신이나 치료제를 개발하는 데 큰 도움을 줄 것으로 기대된다.
김빛내리 서울대 생명과학부 석좌교수 겸 기초과학연구원(IBS) RNA연구단장은 “mRNA가 세포 안으로 들어가고 분해되는 데 관여하는 핵심 단백질들과 조절 경로를 밝혀냈다”고 4일 발표했다. 연구 결과는 이날 국제 학술지 사이언스(Science)에 온라인 게재됐다.

mRNA 백신과 치료제 시장은 신종 코로나바이러스 감염증(코로나19) 대유행 이후 빠르게 성장하고 있다. 시장 조사업체인 모르도르 인텔리전스(Mordor Intelligence)에 따르면 시장 규모가 올해 약 639억달러(약 92조8000억원)에서 2030년에는 1389억달러(201조7000억원)까지 커질 전망이다.
◇백신 mRNA의 세포 유입 과정 해독
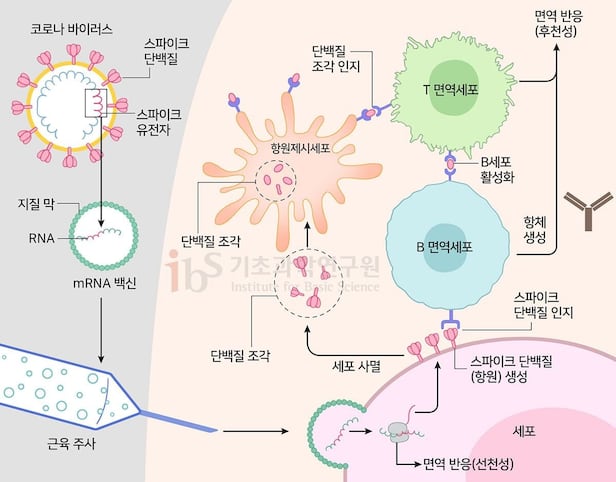
인간은 유전물질인 DNA(디옥시리보핵산)에 유전자가 있다. 코로나바이러스는 RNA(리보핵산)에 갖고 있다. 생명체는 유전자에서 일부 정보를 mRNA로 복사해 원하는 단백질을 만든다. 단백질은 생명체의 모든 현상을 관장한다. 유전자가 단백질 정보를 담은 저장소라면, mRNA는 원하는 단백질을 만드는 설계도인 셈이다. 코로나19 대유행 때 인류를 구한 백신이 바로 mRNA로 만들었다.
김 교수 연구진은 백신의 mRNA가 인체에 들어가는 과정을 해독했다. 당시 mRNA를 구성하는 천연 염기 성분을 N1-메틸수도유리딘이라는 인공 염기로 바꿔 과도한 면역 반응을 피하고 단백질 생산이 잘 일어나도록 했다. 연구진은 이 변형 염기가 어떻게 백신의 효능을 높였는지, 원리가 무엇인지 밝혀냈다.
연구진은 크리스퍼 유전자가위를 이용해 유전자를 하나하나 제거해가면서 특정 형질이나 세포 반응에 영향을 미치는 유전자를 찾았다. 유전자 가위는 원하는 유전자를 잘라내는 효소 복합체이다. 연구진은 2만개가 넘는 유전자를 분석했다.
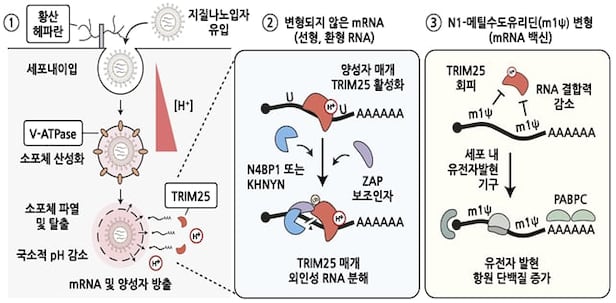
실험 결과 세포막 표면에 있는 황산 헤파란 분자가 백신에서 mRNA를 보호하는 지질나노입자와 결합해 세포 안으로 들어오도록 촉진하는 것을 확인했다. 황산 헤파란은 황산기가 결합한 당단백질로, 세포막에서 외부 물질을 안으로 유입하는 매개체이다.
mRNA 지질나노입자는 세포에 들어와 물질을 수송하는 소포체 안에 들어가는데, 지질나노입자가 소포체 막을 일시적으로 깨는 역할도 한다. 이 막이 깨지는 덕분에 mRNA가 세포질로 방출돼 단백질을 합성하게 된다.
연구진은 mRNA를 막는 단백질도 찾았다. 세포질에 있는 ‘TRIM25’ 단백질이 mRNA를 침입자로 인식하고 제거했다. 하지만 천연 염기가 N1-메틸수도유리딘으로 바뀐 백신의 mRNA에는 잘 달라붙지 못해 자르거나 분해하지 못한다는 사실도 발견했다. N1-메틸수도유리딘 변형 염기가 코로나19 mRNA 백신을 실린 한방 ‘킥’이었던 셈이다.
◇효율 높고 수명 긴 mRNA 백신 개발 가능
mRNA 연구는 백신 개발의 패러다임을 바꿨다. 이전엔 독성을 없앤 바이러스나 일부 단백질를 주사해 면역반응을 유도했다면, mRNA 백신은 유전정보를 전달해 인체가 직접 바이러스 단백질을 합성하고 그에 맞서는 항체를 생산하도록 하는 방식이다. 카탈린 커리코(Katalin Kariko)와 드류 와이즈만(Drew Weissman)은 mRNA 백신을 개발한 공로로 2023년 노벨 생리의학상을 받았다.
mRNA를 이용하면 바이러스의 독성을 없애거나 단백질을 일일이 만들지 않아도 돼 백신 개발이 빠를 뿐 아니라, 돌연변이 바이러스가 발생해도 바로 mRNA 정보를 바꿔 대응할 수 있다는 장점이 있다. 김빛내리 교수 연구진의 연구 결과는 백신에서 mRNA가 세포로 전달되고 효소에 분해되지 않는 과정을 규명해 앞으로 mRNA 백신과 치료제의 효능을 높이는 데 큰 도움을 줄 수 있다.
김 교수는 “mRNA의 전달을 돕는 황산 헤파란을 활용하는 기술을 개발하면 mRNA 전달 효율을 높일 수 있고, 반대로 mRNA를 파괴하는 물질인 TRIM25를 회피하는 기술을 개발하면 mRNA의 안정성을 높일 수 있다”고 말했다.
그렇게 되면 mRNA를 적게 주입하고도 원하는 면역반응을 얻을 수 있다. 김 교수는 “백신이나 치료제를 개발할 때 많은 양의 mRNA를 넣을 필요가 없어져 효과적이고 부작용 없는 백신, 치료제를 만들 수 있을 것”이라고 말했다. 김빛내리 교수는 앞서 2020년 코로나바이러스의 고해상도 유전자 지도를 완성해 코로나 백신 개발에 기여했다.
mRNA 백신은 코로나19 대유행 이후 희소질환과 암을 정복할 인류의 무기로 떠올랐다. 코로나19 백신을 내놨던 독일 바이온텍은 지난해 폐암 재발을 예방할 수 있는 mRNA 백신 ‘BNT116′에 대한 임상시험에 들어갔다. 역시 코로나 mRNA 백신을 개발한 미국 모더나도 미국 머크(MSD)와 함께 피부암의 일종인 흑색종을 막는 백신 ‘mRNA-4157′에 대한 임상시험을 진행 중이다.
참고 자료
Science(2025), DOI: https://www.science.org/doi/10.1126/science.ads4539
Cell(2020), DOI: https://doi.org/10.1016/j.cell.2020.04.011
출처 조선일보 (원문 링크)